گزارش آزمایشگاه گازهای حقیقی
۱۵,۰۰۰ تومان
مقاله موجود است
گزارش آزمایشگاه گازهای حقیقی عنوان یک گزارش آزمایشگاهی درباره گاز های حقیقی می باشد. در این گزارش با محاسبه نیروهای بین مولکولی علت انحراف این گاز از گاز ایده آل بررسی کردهایم. همچنین حجم مولکولی و معادله حالت واندروالس را محاسبه و نتایج را در گزارش منعکس کردیم.
این گزارش آزمایشگاه در 6 صفحه به صورت word بههمراه فهرست مطالب و کاملا قابل ویرایش آماده دانلود شده است. برای خوانایی بهتر نسخه PDF را هم اضافه نمودیم.
در ادامه بخشهایی از گزارش را باهم مرور خواهیم. همچنین می توانید برای مشاهده سایر مقالات گزارش آزمایشگاه ها به صفحه مخصوص آزمایشگاه وب سایت آقای کافی نت مراجعه بفرمایید.
گزارش آزمایشگاه گازهای حقیقی
گازها به دو دسته ایدهآل یا کامل و غیر ایدهآل یا حقیقی تقسیم میشوند. تمام گازها دارای چهار متغیر فشار (P) ، حجم (V) ، دما (T) و تعداد مولها (n) هستند. باید رابطهای بین این چهار متغیر وجود داشته باشد. قانون ساده گازها رابطه بین دو متغیر را وقتی که دو متغیر دیگر ثابت باشند، بیان میکند. طبق قانون بویل – ماریوت ، وقتی تعداد مولها و دما ثابت باشند، فشار با حجم به نسبت عکس تغییر میکند. گازهای حقیقی
قانون شارل – گیلوساک بیان میکند که در فشار و تعداد مولهای ثابت ، حجم یک گاز با دمای آن نسبت مستقیم دارد و همچنین در حجم و تعداد مولهای گازی ثابت ، فشار آن گاز با دما نسبت مستقیم دارد.
معادله حالت یک گاز کامل ، رابطهای بین چهار متغیر را بیان میکند و بدین صورت میباشد.
: {PV = nRT} {TEX} در این معادله ، ثابت گازهای ایدهآل میباشد. هر گازی که از این معادله تبعیت کند گاز ایدهآل یا کامل است. اما برای گاز گاز ایده آل تعریف مناسبتری نیز وجود دارد. گاز ایده آل گازی است که:
- حجم اشغال شده توسط خود مولکولهای گاز (حجم خودی یا حجم مستثنی شده) قابل صرف نظر یا به عبارتی صفر باشد.
- نیروهای بین مولکولی(شامل نیروهای جاذبه و دافعه) صفر باشد.
هر عاملی که گازها را به این دو شرط اساسی نزدیک کنند، باعث نزدیکی گاز به حالت ایدهآل میشود. مثلا افزایش حجم ، افزایش دما ، کاهش فشار ، کاهش چگالی یا تراکم مولکولها یا غلظت ، همه باعث نزدیک شدن گازها به حالت ایدهآل میشوند.
گازهای حقیقی
در شرایط دما و فشار معمولی ، گازهای حقیقی بطور نسبتا کامل از قوانین گازهای ایدهآل پیروی میکنند. ولی در دماهای پایین و یا در فشارهای بالا یا هر دو مورد ، گازهای حقیقی از گازهای ایدهآل انحراف نشان میدهند.
علل انحراف از حالت ایدهآل
به دلیل وجود نیروهای بین مولکولی و حجم مولکولی خود مولکولهاست. گازهای حقیقی
نیروهای بین مولکولی
در نظریه جنبشی گازها فرض بر این است که بین مولکولهای گاز نیروی جاذبه وجود ندارد. ولی چنین جاذبهای باید وجود داشته باشد، زیرا تمام گازها را میتوان مایع کرد. نیروهای جاذبه مولکولی موجب پیوستن مولکولها به یکدیگر در حالت مایع میشود. دو نیرو بین مولکولها وجود دارد، نیروی جاذبه و نیروی دافعه.
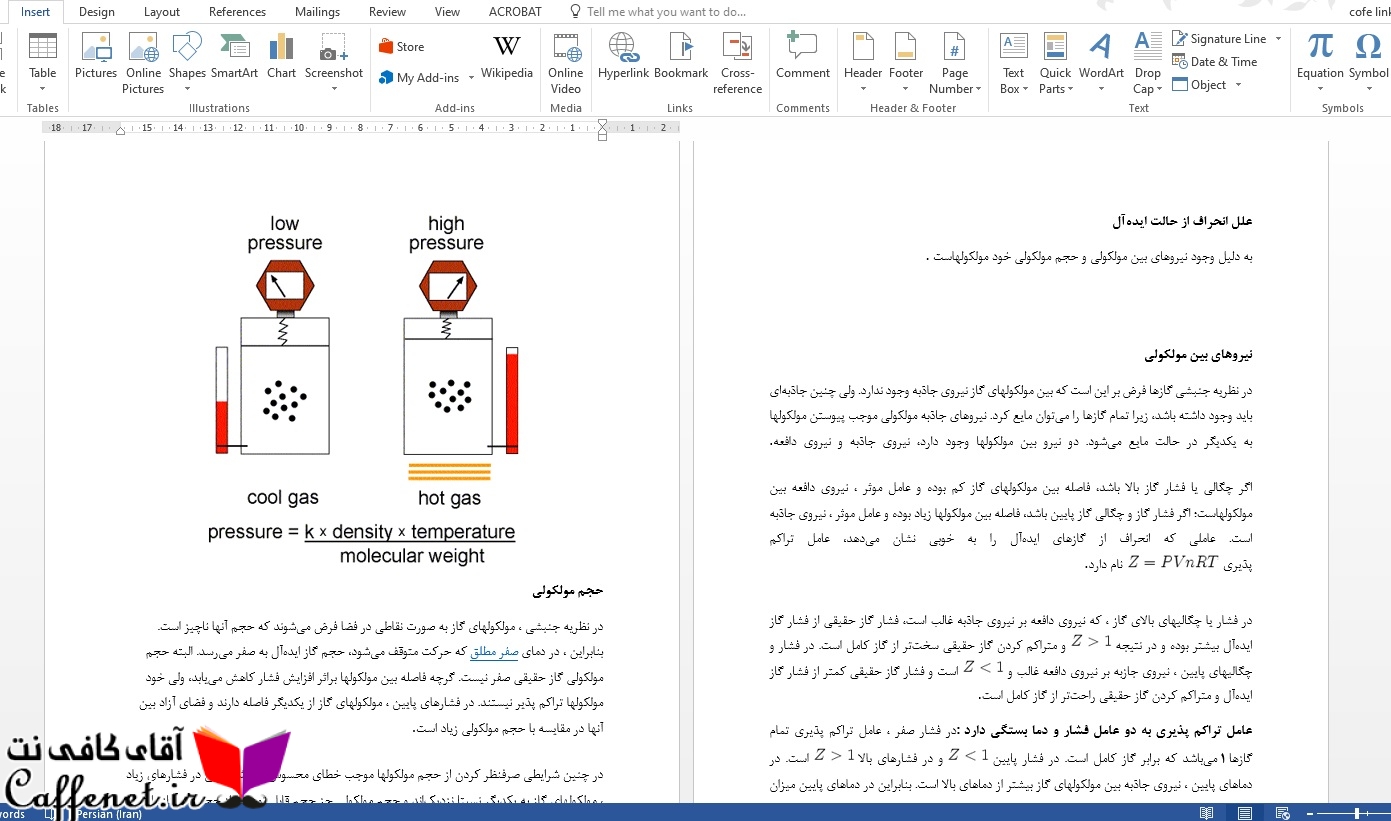
نمونه دو صفحه از گزارش آزمایشگاه گازهای حقیقی
فهرست مطالب
مقدمه
گازهای حقیقی
علل انحراف از حالت ایدهآل
نیروهای بین مولکولی
حجم مولکولی
معادله حالت واندروالس برای گازهای حقیقی
منابع و مآخذ
گزارش آزمایشگاه گازهای حقیقی
| تعداد صفحات | 1-10 |
|---|---|
| فایل PDF | دارد |
| فایل پاورپوینت | ندارد |
| منابع و مآخذ | دارد |
| فایل Word | دارد |
-
۲۵,۰۰۰ تومان
۴۵,۰۰۰ تومانبررسي دگرگوني هاي صادرات و اقتصاد كشور
۲۵,۰۰۰ تومان۴۵,۰۰۰ تومان -
رابطه وفاداری مصرف کنندگان به محصول
نمره 5.00 از 502۸,۹۰۰ تومان۱۲,۰۰۰ تومانرابطه وفاداری مصرف کنندگان به محصول
۸,۹۰۰ تومان۱۲,۰۰۰ تومان -
-
۴۵,۰۰۰ تومان
۵۰,۰۰۰ تومانکاربرد فیزیک و فناوری هسته ای در کشاورزی
۴۵,۰۰۰ تومان۵۰,۰۰۰ تومان -
۲۹,۹۰۰ تومان
۹۶,۰۰۰ تومانحقوق دیه در قوانین جمهوری اسلامی
۲۹,۹۰۰ تومان۹۶,۰۰۰ تومان -
۱۹,۹۰۰ تومان
۲۹,۰۰۰ تومانساختار نظام آموزشي در سند ملي آموزش و پرورش
۱۹,۹۰۰ تومان۲۹,۰۰۰ تومان

















Reviews
There are no reviews yet.