آزمایشگاه شیمی آب و فاضلاب
۱۱,۰۰۰ تومان۲۵,۰۰۰ تومان (-56%)
مقاله موجود است
آزمایشگاه شیمی آب و فاضلاب یک پایان نامه کامل در زمینه رشته شیمی است. در این مقاله به مبحث تصفیه و سالم سازی آب و پساب و آزمایشات مختلف که بر روی آب و پساب می گردد توضیح داده شده است.
این مقاله در 154 صفحه بصورت word بهمراه فهرست مطالب و کاملا قابل ویرایش آماده دانلود است. همچنین برای سهولت در خوانش نسخه PDF مقاله نیز اضافه شد.
در ادامه بخش های مختصری از این مقاله را مرور میکنیم. همچنین برای مشاهده و بررسی سایر مقالات شیمی به صفحه مخصوص شیمی وب سایت آقای کافی نت مراجعه بفرمایید.
آزمایشگاه شیمی آب و فاضلاب
آب يكي از عجيب ترين پديدههاي آفرينش است. بيشتر سطح زمين (حدود سه چهارم) پوشيده از آب است. مجموعه آبهای موجود در کره زمین، Hydrosphere نامیده میشود و برآورد میشود حدود 4/1 ميليارد كيلومتر مكعب آب در سطح كره زمين به صورتهاي گوناگون موجود باشد كه از مقدار تنها حدود 1% به صورت آب شيرين در دسترس بشر است. آب یک عامل مهم برای زندگی جانداران است، به طوریکه حدود 80% پروتوپلاسم سلولهای زنده از آب تشکیل شده است. آزمایشگاه شیمی آب و فاضلاب
آب با نماد شيميايي H2O از دو عنصر هيدروژن و اكسيژن كه در دماي معمولي به حالت گاز هستند تشكيل يافته است. هيدروژن عنصري است كه ميسوزد در حالي كه اكسيژن براي سوزانيدن لازم است. جالب اينجاست كه براي خاموش كردن بسياري از آتشها از آب استفاده ميشود. آبي كه از ايزوتوپ 11H گواراترين نوشيدني است اما D2O يا آب سنگين كه در تشكيل آن Deuterium به كار رفته يك ماده سمي است.
آب یک مولکول قطبی است و به واسطه هیبریداسیون SP3 اتم اکسیژن، این مولکول یک چهاروجهی نامنتظم است. گرچه زوایای پیوندی در این نوع هیبریداسیون 109o.28/ است ولی به سبب حضور دو جفت الکترون غیرپیوندی (N.B) زوایایی بین دو اتم هیدروژن و اکسیژن حدود 105o است. طول پیوند بین O-H حدود 96pm است. (1pm =10-12m)
وجود پیوند هیدروژنی (Hydrogen Bond) میان مولکولهای آب ویژگیهایی را در آب ایجاد میکند که از مهمترین آنها میتوان به نقطه جوش و کشش سطحی(Surface Tension) بالای آن اشاره نمود. اگر پیوند هیدروژنی میان مولکولهای آب موجود نبود این ماده در دمای حدود -100 oC میجوشید.
آب به عنوان یک حلال پدید آورنده بسیاری از محلولهاست. محلولها (Solutions) مهمترین دسته از مخلوطهای همگن (Homogeneous Mixture ) هستند که حاوی ذراتی با قطر 0.1- 2 nm هستند. محلولها شفاف و بیرنگ و یا رنگی بوده و به مرور زمان دولایه نمیشوند. نوع دیگری از مخلوطهای همگن کلوئید (Colloid) نامیده میشوند و حاوی ذراتی با قطر 2-500 nm هستند و گرچه در برابر نور، تیره یا مات هستند ولی به مرور زمان دولایه نمیشوند. آزمایشگاه شیمی آب و فاضلاب
طبقه بندی مواد یونی برحسب انحلالپذیری آنها در آب ، مشکل است. اصولاً هیچ چیز نیست که در آب کاملاً غیرقابل حل باشد. میزان انحلال پذیری مواد حلشونده نسبت به هم بسیار تغییر میکند. افزون بر این برخی مواد ضمن تماس با آب واکنش داده و به عوض انحلال موجب تولید ترکیبات دیگری میشود.
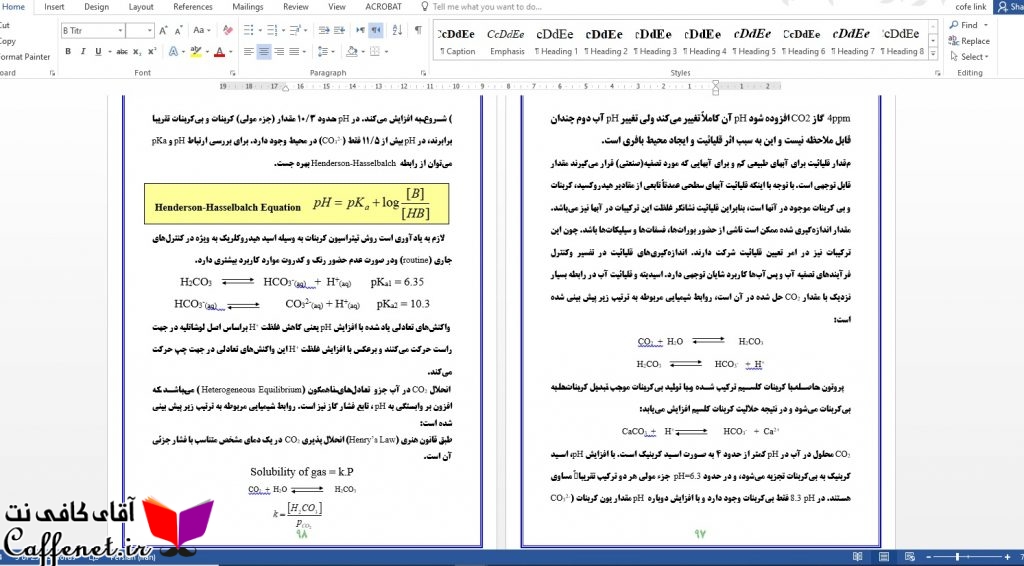
نمونه دو صفحه از آزمایشگاه شیمی آب و فاضلاب
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
با این حال طبقه بندی مندرج در جدول زیر همراه با چند مثال یک دید کلی راجع به پدیده انحلال ارائه میدهد.
| مواد محلول | مواد کم محلول | مواد نامحلول |
| میزان انحلال بیش از 10g/L | میزان انحلال بیش از 1g/L
و کمتر از 10 g/L |
میزان انحلال کمتر از
1g/L |
| تمام نیتراتها و استاتها و کلراتها | CaSO4
Ca(OH)2 Ag2SO4 |
تمام سولفیدها و کربناتها و فسفاتها به جز نمکهای عناصر گروه IA و نمکهای آمونیم |
آب با وجود انواع ناخالصيها هنوز هم يكي از خالص ترين مواد طبيعي است. به جز آب دريا، معمولاً غلظت كل مواد محلول در آب (TDS) در طبيعت كمتر از ppm 600 يا 0.06% است در حالي كه آهك خالص طبيعي 4% ناخالصي دارد. حتي سود سوزآور خالص مورد مصرف در تحقيقات 1% و نمك خوراكي خالص حدود 0.07% ناخالصي دارد. بنابراين آب طبيعي هنوز هم از بسياري مواد تصفيه شده خالصتر است.
آب يك از مشهورترين حلالها است بنابراين نميتوان آنرا به طور كاملاً خالص در طبيعت يافت. عناصر و مواد موجود در آب دريا شاخص خوبي جهت قدرت حلاليت بالاي آب است. به عنوان نمونه يونهاي كلر و سديم با غلظتهاي به ترتيب 19000ppm (1.9% ) و 10500 ppm (1.05%) بيشترين غلظت را در آب دريا دارند. همچنين غلظت عناصري چون جيوه ، نقر ه و طلا در حدود 0.001 ppm قابل اندازهگيري هستند. وجود انواع كاتيونها، آنيونها ، نمكها و تركيبات موجب بروز مزههايي در آب ميشوند كه مهمترين آنها به ترتيب زير است:
مزه شور آب ناشي از حضور Cl– است. اين شوري به ساير تركيبات شيميايي آب بستگي دارد. اگر كاتيون سديم در آبهايي با غلظت كلر 250ppm موجود باشد مزه شور محسوس است. اما اگر كاتيون كلسيم يا منيزيم باشد، چنانچه غلظت کلراید 1000 ppm هم باشد ممكن است مزه شور آشكار نشود.
تلخي آب به خاطر وجود نمكهاي Mg است. مزه گس مربوط به آهن و آلومينيم محلول در آب است. نمكهاي آلي موجب مزه گنديدگي آب ميشوند. آبهايي كه ترش باشند داراي pH<3 بوده و داشتن مزه صابون حاكي از آن است كه pH>9 است.
آب در تشكيل، تكوين و پيشرفت جوامع بشـري نقش بسيـار بزرگي دارد؛ به ويژه در زندگي نوين امروزي آب در موارد گوناگوني از قبيل مصارف آشاميدني، بهداشتي، كشاورزي، دامپروري، توليد نيرو، صنايع و مصارف شهري كاربرد وسيع و ضروري دارد. محدوديت منـابع طبيعي آب قابل مصرف، جلوگيري از مصرف بي رويه آنرا اجباري نموده و از همين رو تصفيه و بازيابي پسابهاي شهري و صنعتي به منظور كاربرد دوباره و جلوگيري از آلودگي محيط زيست، اهميت روزافزوني يافته است.
با وجوديكه حدود 1% از جمعيت جهان در ايران زندگي ميكنند، تنها حدود 26/0 درصد از منابع آب شيرين جهان در كشور ما وجود دارد و برآوردهاي علمي نشان ميدهد كه با افزايش تدريجي جمعيت، ايران تا دو دهه ديگر به طور جدي با مشكل كمبود آب روبهرو خواهد شد؛ به گونهاي كه طبق پيشبينيها، سهم سرانه آب براي هر ايراني در سال 1385 به 1750رسید و این مقدار در سال 1400 به 1300 مترمكعب ميرسد كه كاهش اين سهم به كمتر از 1000 مترمكعب در سال، كشور را با بحران جدي كم آبي روبه رو خواهد كرد.
1) آبهاي صنعتي Industrial Waters
آب در صنايع كاربردهاي بسيار وسيعي دارد كه مهمترين آنها به ترتيب زير است:
- آب به عنوان ماده اوليه در صنايع مختلف مانند صنايع غذايي و دارويي.
- آب جوشاورها(Boilers ) جهت توليد انرژي در نيروگاهها يا واحدهاي توليد برق در صنايع پتروشيمي و پالايش نفت.
- آب به عنوان عامل سرد كننده در برجهاي خنك كننده(Cooling Towers ) و مبدلهاي حرارتي(Heat exchangers)
- آب در خدمت مصارف عمومي كارخانجات و صنايع.
آزمایشگاه شیمی آب و فاضلاب
به طور كلي آبي كه در صنعت مصرف ميشود داراي يك خواص عمومي مشترك است با اين حال با توجه به نوع صنعت، هر صنعتي آب با خواص ويژه را به كار ميبرد. به طور كلي حداقل شرايط لازم براي كاربرد آب در مصارف صنعتي شامل شرايط زير است:
- آب بايد عاري از مواد معلق(Suspended materials ) ، نمكها(Salts) و رسوبات(Deposits ) زياد بوده و براي بهكارگيري در برخي صنايع داراي مشخصات و شرايط آب مشروب باشد.
- آب بايد بدون مواد روغني، مواد فنلي، مواد مربوط به پودرهاي پاككننده، كف و همچنين عناصر شيميايي زيانآور بوده و عاري از مواد تخليه شده مربوط به فاضلابهاي شهري، صنعتي و كشاورزي باشد.
- در آب نبايد موادي وجود داشته باشد كه توليد رنگ و بوي نامطبوع كند و همچنين از نظر فيزيكي پارهاي از مشخصات مربوط به آب آشاميدني(Drink Water ) و ويژگيهاي فيزيكي آب مشروب را دارا باشد.
به عنوان مثال مقادير نوعي زير ميزان مصرف آب يا توليد پساب در برخي صنايع را نشان ميدهد.
- در صنعت نساجي حدود 100 ليتر آب براي رنگرزي يك كيلوگرم از الياف بهكار رود.
- كارگاههاي توليد قطعات ريزالكترونيكي (با روزانه توليد حدود 5000 قطعه)، تقريباً 5 ميليون ليتر پساب شامل حلال آلي و آب ايجاد ميكنند.
- براي توليد هر تن آلومينيم حدود 1350 متر مكعب آب به كار ميرود.
- براي توليد هر تن فولاد حدود 250 متر مكعب آب مورد نياز است.
- براي توليد هر خودرو حدود 40 تن يا به عبارتي حدود 40 متر مكعب آب مورد نياز است.
- براي توليد هر تن كاغذ حدود 2400 متر مكعب آب به كار ميرود.
- براي توليد هر تن مواد شيميايي حدود 200 متر مكعب آب به كار ميرود.
- براي توليد هر تن شكر حدود 100 متر مكعب آب به كار ميرود.
- براي توليد هر تن چرم حدود 6 متر مكعب آب به كار ميرود.
10- براي تصفيه هر بشكه نفت حدود 12-4 متر مكعب آب به كار ميرود.
11- هر نيروگاه برق(Power Station) براي توليد 1Kw.h حدود 200 ليتر آب مصرف ميكند.
پژوهشهاي آماري بسياري درباره مصرف آب در كشورهاي پيشرفته انجام گرفته و در نهايت ميزان مصرف آشكار آب براي هر نفر در روز حدود 300 ليتر و مصرف نهايي آب براي هر فرد مطابق جدول زير چيزي حدود 6 هزار ليتر برآورد شده است. آزمایشگاه شیمی آب و فاضلاب
| محل مصرف | ميزان مصرف به ليتر |
| كشاورزي و توليد فرآوردههاي غذايي | 2600 |
| انرژي الكتريكي و سوخت | 2400 |
| صنايع و معادن | 700 |
| امور خدمات و بازرگاني | 34 |
در جدول (1) مهمترين ناخالصيهاي آبهاي صنعتي و شيوه حذف آنها به طور فهرستوار آورده شده است.
جدول(1)، مهمترين ناخالصيهاي آب و شيوه حذف آنها
| شماره | نوع ناخالصي | فرمول شيميايي | اشكالي كه ايجاد ميكند | شيوه حذف |
| 1 | كدورت | – | بد منظره كردن آب،
تداخل در روشهاي تصفيه |
انعقاد، ته نشيني و صاف كردن |
| 2 |
رنگ |
– |
ايجاد كف در ديگهاي بخار، ممانعت از ترسيب فسفات و باقيماندن در محصولات صنعتي | انعقاد، ته نشيني و صاف كردن و تصفيه با ذغال فعال |
| 3 | سختي كل | بر اساس CaCO3 | ايجاد سارويه در مبدلهاي حرارتي، ديگهاي بخار، لولههاي انتقال آب گرم و تداخل در رنگرزي | نرمسازي با روشهاي گوناگون و بهكارگيري مواد فعال سطحي |
| 4 |
قليائيت |
HCO3–
CO32- OH– |
ايجاد كف و انتقال مواد جامد در ديگهاي بخار، ايجاد شكنندگي قليايي، توليد CO2 به سبب تجزيه كربنات و بيكربنات
آزمایشگاه شیمی آب و فاضلاب |
نرمسازي با فرآيندها لايم و لايم سودا، تبادل يوني، نمكزدايي |
| 5 | اسيدهاي معدني آزاد | H2SO4
HCl |
خورندگي | خنثي كردن با بازها |
| 6 | دياكسيد كربن | CO2 | خوردگي در لولههاي انتقال آب و بخار | هوادهي، تهويه و خنثي كردن با مواد قليايي |
| 7 | تغييرات pH | – | ايجاد خاصيت اسيدي يا بازي در آب | خنثي كردن با افزودن اسيد يا باز |
| 8 | سولفات | SO42- | بالا بردن ميزان مواد جامد محلول آب | نمكزدايي، تقطير |
| 9 | كلرايد | Cl– | بالا بردن ميزان مواد جامد محلول آب | نمكزدايي، تقطير |
| 10 | فلورايد | F– | از نظربهداشتي، زياد و كم بودن آن بر سلامت دندانها موثر است و از نظر صنعتي چندان مهم نيست. | جذب با هيدروكسيد منيزيم يا فسفات كلسيم و انعقاد با زاج |
| 11 | سيليس | SiO2 | رسوب در ديگهاي بخار و لولههاي سرد كننده و پرههاي توربيني و تبخيركنندهها | حذف به كمك اكسيد منيزيم، جذب در رزينهاي آنيوني، قليايي كردن، نمكزدايي و تقطير |
ادامه جدول (1)، مهمترين ناخالصيهاي آب و شيوه حذف آنها
| شماره | نوع ناخالصي | فرمول شيميايي | اشكالي كه ايجاد ميكند | شيوه حذف |
| 12 |
آهن و منگنز |
Fe2+
Fe3+ Mn2+ |
ايجاد رنگ در آبها، ترسيب در لولههاي آب رساني و ديگهاي بخار، تداخل در رنگرزي و تهيه كاغذ و لباسشوييها | هوادهي، انعقاد و صاف كردن، نرمسازي لايم، رزينهاي كاتيوني و جذب به كمك برخي مواد |
|
13 |
مواد نفتي |
– |
ترسيب، كف در ديگهاي بخار، ايجاد اشكال در تبادل حرارت، ايجاد اشكال در روشهاي تصفيه | جداكردن با مايع، انعقاد و صاف كردن(صافي دياتومه) |
| 14 |
اكسيژن |
O2 |
خوردگي در لولههاي آب و بخار | ايجاد خلاء، اكسيژنزداهاي شيميايي نظير سولفيت سديم و مواد پيشگيري از خوردگي |
| 15 | آمونياك | NH3 | خوردگي لولههاي مسي و آلياژهاي روي | مبادله كاتيوني، سيكل هيدروژن، كلرزني و خلاء |
| 16 | سولفيد هيدروژن | H2S | بوي تعفن و خورندگي | هوادهي، كلرزني و مبادله يوني |
| 17 | مواد محلول | Dissolved Solids | در مقادير زياد كاربردهاي صنعتي آب را محدود ميكند. | روشهاي مختلف نرم كردن، نمك زدايي و تقطير |
| 18 | مواد معلق | Suspended Solids | ترسيب در مسيرهاي جريان آب | انعقاد و لختهسازي، تهنشيني و صاف كردن |
| تعداد صفحات | بیش از 100 |
|---|---|
| فایل PDF | دارد |
| فایل پاورپوینت | ندارد |
| منابع و مآخذ | دارد |
| فایل Word | دارد |
-
۱۴,۹۰۰ تومان
۲۵,۰۰۰ تومانقصاص در قانون مجازات ایران
۱۴,۹۰۰ تومان۲۵,۰۰۰ تومان -
-
۱۹,۹۰۰ تومان
۳۵,۰۰۰ تومانبررسي ميزان افسردگي دانش آموزان
۱۹,۹۰۰ تومان۳۵,۰۰۰ تومان -
۴۹,۰۰۰ تومان
۱۰۰,۰۰۰ تومانپاورپوینت تنظیم رژیم غذایی
۴۹,۰۰۰ تومان۱۰۰,۰۰۰ تومان -
۴۹,۹۰۰ تومان
۹۵,۰۰۰ تومانپاورپوینت اجزا ماشین ، فنر
۴۹,۹۰۰ تومان۹۵,۰۰۰ تومان -
پاورپوینت آموزش انواع پاس در والیبال
نمره 5.00 از 501۱۰,۰۰۰ تومانپاورپوینت آموزش انواع پاس در والیبال
۱۰,۰۰۰ تومان











Reviews
There are no reviews yet.